อ้างอิง:
ข้อความเดิมเขียนโดยคุณ Influenza_Mathematics
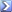
สารประกอบชนิดหนึ่งประกอบด้วยธาตุ 3 ชนิด คือ C,H,O เมื่อนำสารประกอบนี้ 1 g มาเผากับ $O_2$ ที่เกินพอแ้ล้วปล่อยให้แก๊สที่เกิดขึ้นทั้งหมดผ่าน $CaCl_2$ ที่อบแห้งแล้วหนัก 20 g และสารละลาย $Ca(OH)_2$ อิ่มตัวหนัก 500 g ตามลำดับ เมื่อปฎิกิริยาเสร็จสิ้นสมบูรณ์แล้ว ปรากฎว่า $CaCl_2$ มีมวล 20.46 g และ สารละลาย $Ca(OH)_2$ อิ่มตัวมีมวลเป็น 501.49 g จงหามวลสูตรอย่างง่ายของสารประกอบนี้  |
$CaCl_2$ เป็นสารดูดความชื้น
$Ca(OH)_2$ เป็นน้ำปูนใส เมื่อผ่านแก๊ส $CO_2$ เข้าไปจะทำให้เกิดตะกอน
ตามกฏทรงมวลแสดงว่าน้ำหนักที่เพิ่มขึ้นมาจาก $H_2O$ = 0.46 g และ $CO_2$ = 1.49 g
จาก
$C,H,O + O_2 = CO_2 + H_2O$
มวล C = $\frac{12}{44}\times 1.49$ = 0.406 g
มวล H = $\frac{2}{18}\times 1.49$ = 0.051 g
มวล O= 1-0.406-0.051 = 0.543 g
อัตราส่วนโมล C:H:O
$\frac{0.406}{12} :\frac{0.051}{1} :\frac{0.543}{16} $
$0.034:0.051:0.034$
$2:3:2$
สารประกอบนี้มีสูตรอย่างง่ายเป็น $C_2H_3O_2$
คำตอบออกมาแปลกๆ
