อ้างอิง:
ข้อความเดิมเขียนโดยคุณ James007
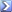
1. ในสารละลายแรก $\rm{HCl} \rightarrow \rm{H^+}+\rm{Cl^-}$
$\rm{HCl}$ มีปริมาณ $0.2 \ \rm{mol/L} \times 50 \rm{cm^3} = 0.01 \ \rm{mol}$
ได้ $\rm{Cl^-}$ ปริมาณ $0.01 \ \rm{mol}$
ในสารละลายที่สอง $\rm{NH_4OH} \rightarrow \rm{NH_4^+}+\rm{OH^-}$
$\rm{NH_4OH}$ มีปริมาณ $0.1 \ \rm{mol/L} \times 50 \rm{cm^3} = 0.005 \ \rm{mol}$
ได้ $\rm{NH_4^+}$ ปริมาณ $0.005 \ \rm{mol}$
ดังนั้น ในสารละลายรวม ที่มีปริมาตร $50 + 50 \ \rm{cm^3}=100 \ \rm{cm^3}$ จะมี $\rm{NH_4Cl}$ ปริมาณ $0.005 \ \rm{mol}$
นั่นคือ สารละลายนี้จะมีความเข้มข้นของ $\rm{NH_4Cl}$ เท่ากับ $\dfrac{0.005 \ \rm{mol} }{100 \ \rm{cm^3}} = 0.05 \ \rm{mol/L}$
|
ขอบคุณครับ ผมทำแบบนี้ได้ปะครับ
$HCl + NH_3 \rightarrow NH_4Cl$
$mol_{HCl} = 0.01 mol, mol_{NH_3}= 0.005 mol$ แสดงว่า ปริมาณ$NH_3$ หมดก่อน$HCl$
จะได้ว่า $NH_4Cl$ เกิด $0.005 mol$ ในสารละลาย $100 cm^3$
$1000 cm^3$ เกิด $0.05 mol$ หรือ $0.025 mol/dm^3$